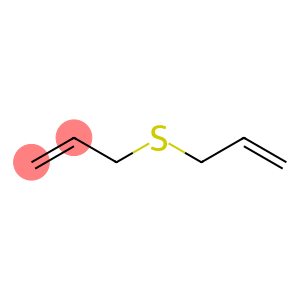
Solfuro di allile (CAS#592-88-1)
| Simboli di pericolo | Xi – Irritante |
| Codici di rischio | R10 – Infiammabile R36/37/38 – Irritante per gli occhi, le vie respiratorie e la pelle. |
| Descrizione di sicurezza | S26 – In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico. S36 – Indossare indumenti protettivi adatti. S37/39 – Usare guanti adatti e proteggersi gli occhi/la faccia S23 – Non respirare i vapori. S16 – Tenere lontano da fonti di ignizione. |
| ID ONU | ONU 1993 3/PG 3 |
| WGK Germania | 2 |
| RTECS | BC4900000 |
| TSCA | SÌ |
| Codice SA | 29309070 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | III |
Introduzione
Il solfuro di allile è un composto organico. Ha le seguenti proprietà:
Proprietà fisiche: il solfuro di allile è un liquido incolore con un forte odore pungente.
Proprietà chimiche: il solfuro di allile è in grado di reagire con molti composti, in particolare con reagenti elettrofilici, come alogeni, acidi, ecc. Può subire reazioni di polimerizzazione in determinate condizioni.
Principali usi del solfuro di allile:
Come intermedio: il solfuro di allile può essere utilizzato come intermedio nella sintesi organica e partecipare a una serie di reazioni di sintesi organica, ad esempio può essere utilizzato per sintetizzare aloolefine e composti eterociclici di ossigeno.
Esistono diversi metodi principali per la preparazione del solfuro di allile:
Reazione di sostituzione dell'idrotiolo: il solfuro di allile può essere formato da reazioni come il bromuro di allile e l'idrosolfuro di sodio.
Reazione di conversione dell'alcol allilico: preparata dalla reazione dell'alcol allilico e dell'acido solforico.
Dal punto di vista della sicurezza, il solfuro di allile è una sostanza irritante che può causare irritazioni e danni a contatto con la pelle e gli occhi. Evitare il contatto diretto con la pelle e gli occhi durante l'utilizzo e mantenere buone condizioni di ventilazione. Il solfuro di allile è volatile e dovrebbe essere evitato in caso di esposizione prolungata ad alte concentrazioni di vapori o gas.